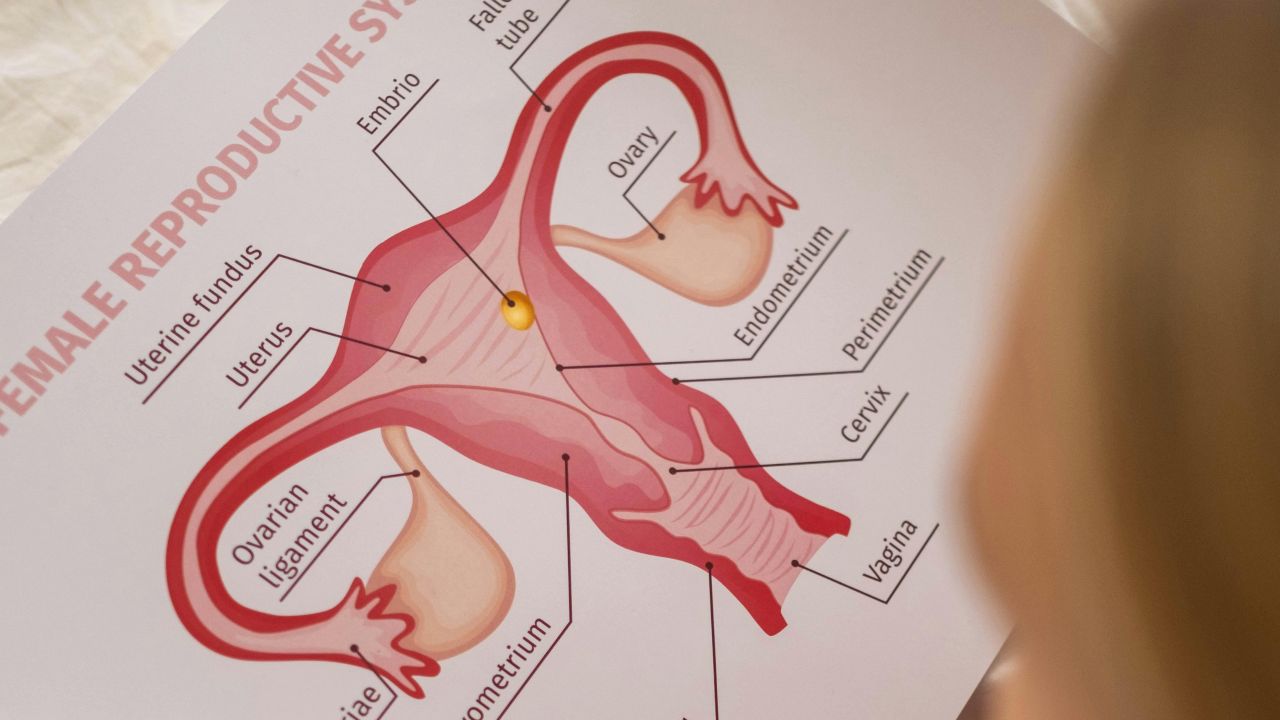
¿Qué es la estimulación ovárica?
Se trata de la estimulación hormonal de los ovarios mediante comprimidos o inyecciones para que crezcan múltiples folículos. En IVF/ICSI los ovocitos se extraen mediante punción; en IUI normalmente se busca 1–3 folículos maduros para limitar el riesgo de embarazos múltiples. El paso final de maduración se provoca con una inyección de “trigger” (hCG o agonista de GnRH).
Objetivos y expectativas realistas
Una estimulación exitosa no significa “el mayor número posible de ovocitos”, sino “suficientes, seguros y de buena calidad”. El óptimo depende de la edad, AMH/AFC, antecedentes, el método (IUI vs. IVF/ICSI) y la capacidad del laboratorio. Buenas clínicas ajustan dosis y tiempos para equilibrar probabilidad y seguridad; esto se destaca en recomendaciones internacionales (NICE, ESHRE).
Unite a nuestra comunidad de donación de esperma
Seguro, respetuoso y confiable.
Hacete miembro ahoraProtocolos
Protocolo con antagonista (breve)
Frecuentemente el estándar: inyecciones diarias de FSH/hMG desde el día 2–3 del ciclo; cuando los folículos crecen, un antagonista de GnRH evita el aumento prematuro de LH. Trigger al final con hCG o agonista de GnRH. Ventajas: flexibilidad, buen perfil de seguridad y menor riesgo de OHSS.
Protocolo con agonista (largo)
Supresión con agonista de GnRH antes del inicio de la estimulación y luego FSH/hMG. Útil en indicaciones selectas, aunque de mayor duración y con potenciales más efectos secundarios.
Estimulación leve / natural modificada
Dosis más bajas de gonadotropinas o comprimidos (letrozol/clomifeno), con foco en menos pero suficientes ovocitos. Puede reducir efectos secundarios y costos; no es adecuada para todos los perfiles. Resumen comprensible para pacientes en la HFEA.
Medicamentos
| Clase | Finalidad | Ejemplos | Observaciones |
|---|---|---|---|
| Gonadotropinas (FSH/hMG) | Crecimiento folicular | Plumas FSH, hMG | Dosis según AMH, AFC, edad, IMC, antecedentes |
| Antagonista de GnRH | Evita el aumento prematuro de LH | Cetrorelix, Ganirelix | Frecuente en el protocolo corto |
| Agonista de GnRH | Supresión / opción de trigger | Leuprorelina, Triptorelina | Como trigger reduce el riesgo de OHSS |
| Orales | Estimulación, sobre todo en IUI o protocolos leves | Letrozol, Clomifeno | Más económico, menor número de ovocitos |
| Progesterona | Apoyo en la fase lútea | Cápsulas vaginales / gel | Estándar después de IVF/ICSI |
Resúmenes sobre fármacos orientados a pacientes: HFEA: Fertility drugs.
Monitoreo y criterios de inicio
Antes de empezar se evalúan anamnesis, ecografía (AFC), perfil hormonal (incl. AMH) y, según la región, cribados infecciosos para estimar el riesgo de base. Durante la estimulación, 2–4 controles ecográficos y según el caso mediciones de estradiol ajustan dosis y el momento del trigger.
- Criterios de inicio: AMH/AFC, edad, IMC, patrón del ciclo, tratamientos previos, comorbilidades.
- Tamaños objetivo: en IUI suelen buscarse 1–3 folículos dominantes; en IVF/ICSI se apunta a un número moderado de ovocitos de calidad.
- Trigger: con folículos dominantes aprox. 17–20 mm (depende de la clínica).
Recomendaciones generales sobre el manejo pueden consultarse en NICE y en la guía ESHRE.
Proceso paso a paso
- Inicio: día 2–3 del ciclo con comprimidos o inyecciones.
- Controles: ecografía y, si procede, E2 para ajustar la dosis; antagonista si hay crecimiento folicular suficiente.
- Trigger: hCG o agonista de GnRH para la maduración final.
- Procedimiento siguiente: punción para IVF/ICSI ~34–36 h después del trigger; IUI según la indicación y tiempos tras la ovulación.
- Fase lútea: progesterona según el protocolo de la clínica.
Más información: visión general de métodos IVF/ICSI, IUI y diferenciación frente a ICI/inseminación domiciliaria.
Éxito y rendimiento de ovocitos
Las tasas de éxito dependen en gran medida de la edad, la causa de la infertilidad, la cadena del laboratorio y la etapa embrionaria. Muchos centros buscan un número medio de ovocitos en IVF/ICSI; en IUI suele bastar un folículo dominante. Las guías recomiendan basar la elección de protocolo y dosis en el riesgo individual, no en cifras máximas (ESHRE).
Seguridad y prevención de OHSS
El OHSS (síndrome de hiperestimulación ovárica) es infrecuente pero importante. Factores de riesgo: AMH/AFC altos, SOP, edad joven, niveles elevados de E2, dosis agresivas. Medidas preventivas: protocolo con antagonista, dosificación conservadora, trigger con agonista de GnRH, en su caso estrategia de “freeze-all” y monitoreo estrecho. Signos de alarma: aumento rápido de peso, aumento del perímetro abdominal/dolor, dificultad respiratoria, vómitos persistentes. Información para pacientes: NHS sobre OHSS.
Apoyo en la fase lútea
Después de IVF/ICSI el apoyo con progesterona es estándar; tras IUI su uso varía internacionalmente. Formas: gel vaginal, cápsulas vaginales, menos frecuentemente inyecciones. La duración suele ser hasta la prueba de embarazo o hasta el inicio del embarazo temprano, según el protocolo de la clínica.
Comparación y alternativas
| Enfoque | Típico para | Ventajas | A tener en cuenta |
|---|---|---|---|
| Protocolo con antagonista | IVF/ICSI | Flexible, menor riesgo de OHSS | Inyecciones diarias, densidad de controles |
| Protocolo con agonista | Indicaciones selectivas | Planificable, ventajas técnicas para el laboratorio | Mayor duración, posibles más efectos adversos |
| Leve / natural modificada | IUI, IVF leve | Menos efectos adversos, a veces menor costo | Menor número de ovocitos; no adecuado para todos los perfiles |
Opciones con menor carga farmacológica explicadas de forma comprensible por la HFEA.
¿Cuándo consultar con la médica o el médico?
Consultar de inmediato ante dolor abdominal intenso, dificultad respiratoria, vómitos persistentes, mareos, aumento rápido de peso o aumento marcado del perímetro abdominal durante o después de la estimulación. También debe revaluarse la estrategia si no hay crecimiento folicular, si aparecen repetidamente demasiados folículos para una IUI o si hay efectos adversos importantes. La estimulación ovárica debe realizarse siempre bajo supervisión médica con un esquema de monitoreo estructurado.
Conclusión
A nivel internacional se recomienda: planificar de forma individual, monitorizar de cerca y gestionar activamente los riesgos. Con la elección adecuada del protocolo, una dosificación conservadora, un trigger seguro y señales de alarma claras, la estimulación ovárica puede llevarse a cabo de forma eficaz y responsable, tanto para IUI como para IVF/ICSI.